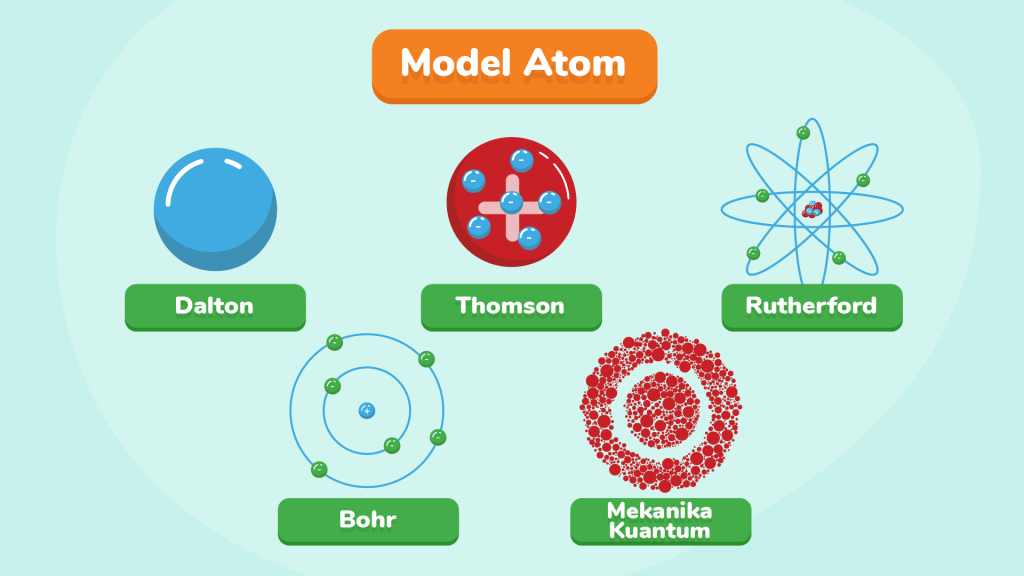
Model Atom Dalton: Bola Pejal Yang Membawa Misteri
Dalam dunia ilmu kimia, John Dalton adalah tokoh pertama yang mencoba memberikan gambaran tentang struktur atom. Model atom Dalton pada awalnya menjadi pijakan bagi pemahaman kita tentang atom. Dalton mendefinisikan atom sebagai sebuah bola pejal yang sangat kecil, yang tidak dapat dibagi lagi. Ia juga mengklaim bahwa atom-atom dari unsur yang berbeda memiliki massa dan sifat yang berbeda. Ketika atom bergabung, mereka membentuk senyawa dalam perbandingan bilangan bulat yang sederhana. Misalnya, air terdiri dari atom-atom hidrogen dan atom-atom oksigen.
Salah satu hal menarik tentang model atom Dalton adalah pandangan bahwa reaksi kimia hanya melibatkan pemisahan, penggabungan, atau penyusunan ulang atom-atom. Oleh karena itu, dalam pandangan Dalton, atom tidak dapat diciptakan atau dimusnahkan. Model atom Dalton diperkuat oleh dua hukum alam penting: Hukum Kekekalan Massa (hukum Lavoisier) dan Hukum Perbandingan Tetap (hukum Proust). Hukum Kekekalan Massa menyatakan bahwa massa zat sebelum dan sesudah reaksi adalah sama, sedangkan Hukum Perbandingan Tetap menyatakan bahwa perbandingan massa unsur-unsur yang menyusun zat adalah tetap.
Namun, model atom Dalton juga memiliki kelemahan yang signifikan. Salah satunya adalah ketidakmampuannya untuk menjelaskan reaksi nuklir, di mana atom dapat berubah menjadi atom lain. Selain itu, teori ini juga gagal menjelaskan mengapa larutan dapat menghantarkan arus listrik. Bagaimana mungkin sebuah "bola pejal" dapat menghantarkan arus listrik, sedangkan listrik melibatkan pergerakan elektron? Ini menimbulkan pertanyaan-pertanyaan yang mendalam tentang struktur atom.
Model Atom Thomson: Elektron Dalam Roti Kismis
Setelah Dalton, penemuan elektron oleh J.J. Thomson membawa perkembangan besar dalam pemahaman struktur atom. Thomson mengembangkan model atom yang disebut model atom Thomson, yang merupakan penyempurnaan dari model atom Dalton. Dalam model ini, atom dijelaskan sebagai sebuah bola pejal dengan muatan positif yang merata, dan di dalamnya tersebar elektron seperti kismis dalam roti kismis.
Salah satu kelebihan besar dari model atom Thomson adalah bahwa ia membuktikan adanya partikel bermuatan negatif dalam atom. Ini adalah langkah besar dalam memahami struktur atom yang lebih kompleks daripada yang dikemukakan oleh Dalton. Model Thomson berhasil menjelaskan eksperimen-defleksi elektron, yang merupakan bukti konkret dari keberadaan elektron dalam atom.
Namun, model ini juga memiliki kelemahan. Model Thomson tidak mampu menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut. Ini menimbulkan pertanyaan tentang bagaimana atom sebenarnya terstruktur di dalamnya.
Model Atom Rutherford: Inti Atom yang Bersemayam
Eksperimen Rutherford mengguncang dasar-dasar pemahaman tentang atom. Rutherford menemukan bahwa dalam atom terdapat inti atom yang bermuatan positif. Inti atom ini jauh lebih kecil dari ukuran atom secara keseluruhan, tetapi hampir seluruh massa atom berasal dari inti tersebut. Model atom Rutherford mendefinisikan atom sebagai sebuah inti atom yang bermuatan positif dan berada di pusat atom, dengan elektron-elektron yang bergerak mengelilingi inti seperti planet dalam tata surya.
Salah satu kelemahan besar dari model atom Rutherford adalah ketidakmampuannya untuk menjelaskan mengapa elektron tidak jatuh ke inti atom akibat gaya tarik elektrostatis inti terhadap elektron. Menurut teori elektromagnetik Maxwell, jika elektron sebagai partikel bermuatan bergerak mengelilingi inti yang memiliki muatan yang berlawanan, maka lintasannya akan berbentuk spiral dan akhirnya akan kehilangan tenaga dalam bentuk radiasi, sehingga elektron seharusnya jatuh ke inti. Ini adalah masalah serius yang dikenal sebagai "masalah stabilitas atom Rutherford."
Namun, model atom Rutherford juga memiliki kelebihan. Ia memperkenalkan gagasan inti atom, yang menjadi dasar bagi perkembangan teori atom selanjutnya. Ide bahwa hampir seluruh massa atom terkonsentrasi dalam inti atom adalah ide yang sangat penting dalam pemahaman struktur atom.
Model Atom Niels Bohr: Pionir Teori Kuantum dalam Atom
Model atom Niels Bohr adalah langkah penting dalam perjalanan pemahaman struktur atom. Model Bohr didasarkan pada teori kuantum, yang membantunya menjelaskan spektrum garis gas hidrogen. Bohr berpendapat bahwa spektrum garis menunjukkan bahwa elektron hanya dapat menempati tingkat energi tertentu dalam atom.
Bohr menjelaskan atom hidrogen dengan empat postulat. Pertama, hanya ada sejumlah orbit tertentu yang diperbolehkan bagi satu elektron dalam atom hidrogen, dan orbit tersebut disebut sebagai "keadaan gerak stasioner" elektron. Kedua, selama elektron berada dalam lintasan stasioner, energinya tetap, sehingga tidak ada energi dalam bentuk radiasi yang dipancarkan atau diserap. Ketiga, elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain, dan dalam peralihan ini, sejumlah energi tertentu terlibat. Terakhir, lintasan stasioner yang dibolehkan memiliki besaran yang disebut momentum sudut, yang merupakan kelipatan dari h/2π, di mana h adalah tetapan Planck.
Menurut model atom Bohr, elektron-elektron mengelilingi inti atom pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi. Tingkat energi terendah adalah kulit elektron yang terletak paling dalam, sedangkan semakin ke luar, semakin tinggi tingkat energinya. Model Bohr berhasil menjelaskan fenomena spektrum garis atom hidrogen, yang merupakan langkah besar dalam pemahaman atom.
Namun, model atom Bohr juga memiliki kelemahan. Salah satunya adalah bahwa model ini hanya berlaku untuk atom hidrogen, sehingga tidak dapat menjelaskan struktur atom unsur lain yang lebih kompleks. Selain itu, model ini juga gagal menjelaskan mengapa elektron mengikuti lintasan tertentu tanpa meradiasikan energi, seperti yang diprediksi oleh teori elektromagnetik Maxwell.
Penutup
Perjalanan pemahaman struktur atom dari model atom Dalton hingga Bohr adalah sebuah petualangan ilmiah yang mengagumkan. Setiap model atom telah memberikan kontribusi penting dalam pengembangan ilmu pengetahuan, meskipun mereka memiliki kelebihan dan kelemahan masing-masing. Dalam pengembangan selanjutnya, ilmuwan terus bekerja keras untuk memahami atom dengan lebih baik, dan ini membawa kita kepada pemahaman yang lebih mendalam tentang dunia mikrokosmos ini.
Ketika kita mengingat perjalanan atom ini, kita harus selalu terbuka terhadap penemuan-penemuan baru dan pengembangan-pengembangan lebih lanjut dalam ilmu kimia dan fisika. Struktur atom adalah salah satu misteri paling menarik dalam ilmu pengetahuan, dan selalu ada sesuatu yang baru untuk dipelajari dan dipecahkan. Dengan semangat penelitian yang tak kenal lelah, kita akan terus mengungkap rahasia atom, dan siapa tahu, mungkin suatu saat kita akan memiliki pemahaman yang lebih lengkap tentang atom dan segala keajaiban yang tersembunyi di dalamnya.